再生医療とは、失われた細胞・組織・器官を再生することで、機能を回復させる医療です。
今回の記事では
- 再生医療とは
- 再生医療によって可能になること
- 再生医療における今後の課題
- 安全性確保のための政府の取り組み
について解説します。
本記事がお役に立てば幸いです。
1、再生医療とは

再生医療とは、細胞・組織・器官を人工的に再生し、機能を回復させる医療を指します。
再生治療では、患者の
- 皮膚
- 血管
- 骨
などを培養することで、失った組織や臓器を作り、患者に移植することで、怪我や病気を治療します。
患者自身の細胞を使うため
- 従来の臓器移植より拒絶反応が少ない
- ドナー不足の解消につながる
といったメリットがあります。
2、再生医療によって可能になること
再生医療によって、人間の血液や臓器、筋肉などの人工的な再生が可能になります。
人間の体は約60兆個の細胞から構成されています。
特に「幹細胞」と呼ばれる細胞は、組織を再生する能力があり、怪我をしたときにできる「かさぶた」も幹細胞の再生能力によるものです。
再生医療で代表的な幹細胞である
- ES細胞
- iPS細胞
についてご紹介します。
(1)ES細胞
ES細胞とは、1998年にウィスコンシン大学のジェームズ・トムソン教授が作製した細胞です。
ES細胞は、神経細胞や血液細胞など、さまざまな臓器の細胞に分化(別の細胞に変化すること)する能力があります。
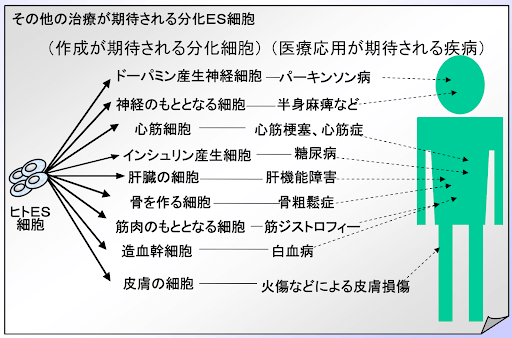 画像引用元:3.ES細胞の多能性と再生医療への期待 ES細胞とは? 文部科学省
画像引用元:3.ES細胞の多能性と再生医療への期待 ES細胞とは? 文部科学省
ただし、ES細胞は受精後の胚(胎児の元)から細胞を取り出して培養するため、倫理上の問題が指摘されているという側面もあります。
(2)iPS細胞
iPS細胞とは、2006年に京都大学の山中伸弥教授が作製した細胞です。
iPS細胞は、受精後の胚から細胞を取り出すのではなく、患者の皮膚細胞などから細胞を作ることができます。
そのため、ES細胞に比べて拒絶反応が少ないです。
参考:iPS細胞を用いた臨床手術に成功! 国立開発研究法人 科学技術振興機構
3、再生医療における今後の課題

再生医療における今後の課題である
- 安全性
- 実用性
について解説していきます。
(1)再生医療の安全性
再生治療を行う上では、安全性の確保が必須です。
再生医療で使用される細胞加工物には、
- ウイルスや細菌の伝播
- 細胞の意図しない変化
- 好ましくない免疫反応
など、さまざまなリスクがあります。
また、ES細胞やiPS細胞では、患者に分化していない細胞が多く残っていると腫瘍ができてしまう可能性があります。
変化しやすい細胞を安定化させ、品質や有効性を維持する製造方法の確立が必要です。
参考:細胞加工物における新たな造腫瘍性評価法の開発 再生医療・遺伝子治療についてかんがえる 日本再生医療学会
(2)再生医療の実用性
再生医療を実用化するためには、実施できる十分な環境整備が必要です。
例えばiPS細胞の臨床研究を行う機関には
- 技術のある胞培養士
- 整備された細胞調製室
など、高い水準の研究環境が必要です。
臨床研究の支援体制の構築が求められています。
参考:iPS細胞を用いた再生医療の課題 再生医療・遺伝子治療についてかんがえる 日本再生医療学会
4、再生医療の安全性確保のための政府の取り組み
国民が安心して再生医療を受けられるよう、政府が整備を進めている
- 再生医療等の安全性確保に関する法律
- 再生医療の関連機関に求める手続き
について解説していきます。
(1)再生医療等の安全性確保に関する法律
再生医療に関する法律には
- 再生医療推進法
- 再生医療等安全性確保法
- 薬事法改正法
の3つの法律があります。
①再生医療推進法
再生医療推進法とは、2013年5月に施行された、再生医療の研究から実用化までの総合的な推進を目的とした法律です。
正式には「再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律」になります。
再生医療の研究・実用化までの具体的な取り組みには
- 法律の整備
- 再生医療を行う環境整備
- 再生医療製品の審査体制の整備
- 人材の確保
などがあります。
参考:再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律(平成25年法律第13号)(概要) 厚生労働省
②再生医療等安全性確保法
再生医療等安全性確保法とは、2014年に施行された、医療として提供される再生医療等の安全性を高めることを目的とした法律です。
正式名は「再生医療等の安全性の確保等に関する法律」になります。
- 採取等の実施手続き
- 再生医療等を提供する医療機関の基準
- 細胞を培養・加工する施設の基準
などを定めています。
参考:1-1. 今後の再生医療の実用化を促進する制度的枠組み 再生医療等の安全性の確保等に関する法律について 厚生労働省
③薬事法改正法
薬事法改正法とは、2014年に施行された、再生医療の実用化に対応することを目的とした法律です。
- 再生医療等製品の特性に応じた早期承認制度の導入
- 患者に対する説明と同意
- 使用者の記録と保存
など規定し、市販後の安全対策も定めています。
参考:1-1. 今後の再生医療の実用化を促進する制度的枠組み 再生医療等の安全性の確保等に関する法律について 厚生労働省
(2)再生医療の関連機関に求める手続き
厚生労働省では
- 再生医療を提供しようとしている医療機関
- 特定細胞加工物を製造しようとしている事業者等
に対する事前の手続きを定めています。
①再生医療を提供しようとしている医療機関
再生医療を提供する医療機関には、「提供計画の提出」を義務付けています。
提供する再生医療を、リスクに応じて第1種から第3種まで区分し、「特定認定再生医療等委員会」による審査を行います。
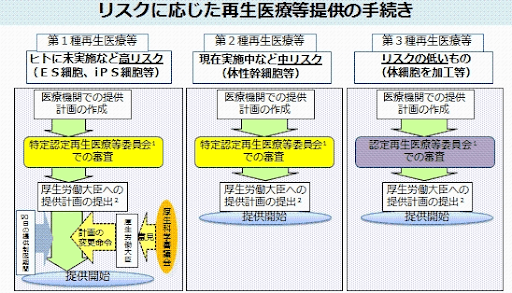 画像引用元:1.再生医療等を提供しようとする場合は、あらかじめ提供計画を提出することが義務づけられています 厚生労働省
画像引用元:1.再生医療等を提供しようとする場合は、あらかじめ提供計画を提出することが義務づけられています 厚生労働省
②特定細胞加工物を製造しようとしている事業者等
特定細胞加工物を製造しようとしている事業者等には、事業者の対象別に
- 届出
- 許可
- 認定
のいずれかを必要としています。
 表引用元:4.細胞培養加工施設で特定細胞加工物を製造しようとする場合、施設毎にあらかじめ手続きが必要です 細胞培養加工施設について(概要) 厚生労働省
表引用元:4.細胞培養加工施設で特定細胞加工物を製造しようとする場合、施設毎にあらかじめ手続きが必要です 細胞培養加工施設について(概要) 厚生労働省
「国内の医療機関」で製造する場合は、管轄の地方厚生局に「特定細胞加工物製造届」を提出します。
「国内の医療機関以外」で製造する場合は、管轄の地方厚生局に
- 「特定細胞加工物製造許可申請書」
- 「特定細胞加工物製造許可調査申請書」
を提出し、PMDAによる調査が行われます。
「国外」で製造する場合は、厚生労働省に
- 「特定細胞加工物製造認定申請書」
- 「特定細胞加工物製造認定調査申請書」
を提出し、PMDAによる調査が行われます。
まとめ
今回は再生医療について解説しました。
再生医療は多くの疾患を救う治療です。
ただし、培養した細胞の人体での変化など、まだ解明されていない部分も多くあります。
安心して再生医療を受けられるよう、安全性と実用性の確保が今後の課題です。